Os produtos de terapia avançada são produtos farmacêuticos inovadores, geralmente empregando células, tecidos ou genes vivos, que visam proporcionar tratamentos mais eficazes e personalizados, oferecendo soluções para condições médicas graves ou crónicas que não são tratadas adequadamente pelas terapias convencionais.
Os produtos de terapia avançada são classificados em três categorias principais: terapia genética, terapia celular e produtos de engenharia de tecidos. Estas abordagens terapêuticas estão em constante desenvolvimento e progresso e, portanto, requerem validações precisas de segurança e eficácia antes da sua aprovação e uso clínico.
Avaliar a qualidade dos produtos de terapia avançada é extremamente importante para garantir a eficácia, segurança e conformidade desses produtos. Esse controle de qualidade e validação pode passar por diferentes metodologias, que devem seguir diretrizes e regulamentações específicas dos órgãos e agências reguladoras correspondentes, como ANVISA (Agência Nacional de Vigilância Sanitária), FDA (Food and Drug Administration) e EMA (Agência Europeia de Medicamentos). ), que fornecem orientações detalhadas sobre os requisitos de qualidade para produtos de terapia avançada.
Neste artigo abordaremos as principais estratégias e metodologias de validação e controle de qualidade de produtos de terapia avançada, alinhados às normas regulamentadoras e às tecnologias de ponta produzidas e utilizadas nacional e internacionalmente.
Metodologias de controle de qualidade e validação:
Existem diversas metodologias e técnicas in vitro e moleculares para validação e controle de qualidade de produtos de terapia avançada. A seguir discutiremos os principais: ensaio de diferenciação celular, quantificação de impurezas e metabólitos, detecção de micoplasma, teste de esterilidade, análise de endotoxinas, detecção e quantificação de DMSO, penicilina e estreptomicina, análise de proteínas totais, imunofenotipagem de CTMs, e virologia molecular.
Ensaio de diferenciação celular
O ensaio de diferenciação celular é uma metodologia importante para o controle de qualidade de produtos de terapia avançada, especialmente aqueles que envolvem produtos de terapia celular ou de engenharia de tecidos. Este teste permite avaliar a capacidade das células se diferenciarem em tipos celulares específicos, de acordo com a finalidade terapêutica desejada.
A diferenciação celular refere-se ao processo pelo qual células indiferenciadas se desenvolvem em células especializadas com funções específicas. No contexto dos produtos de terapia avançada, é essencial garantir que as células utilizadas sejam capazes de se diferenciar corretamente em tipos de células relevantes para a terapia em questão. Por exemplo, se as células estaminais mesenquimais forem utilizadas para tratar lesões teciduais, elas devem diferenciar-se em células teciduais alvo, tais como osteócitos, condrócitos ou adipócitos.
O ensaio de diferenciação celular geralmente envolve as seguintes etapas:
- Cultura de células indiferenciadas:
As células são cultivadas sob condições específicas que favorecem a manutenção do seu estado indiferenciado, geralmente em meios de cultura específicos e placas de cultura apropriadas.
- Indução de diferenciação:
As células são expostas a estímulos específicos ou fatores de crescimento que promovem a diferenciação em tipos celulares desejados. Esses estímulos podem incluir compostos químicos, cocultura com outras células e modificação do ambiente de cultura, entre outros.
- Avaliação de diferenciação:
Após um período de exposição a estímulos de diferenciação, as células são analisadas para verificar se adquiriram características morfológicas, marcadores de superfície ou expressão gênica associada ao tipo celular desejado. Isto pode ser conseguido utilizando técnicas como imunofluorescência, citometria de fluxo, reação em cadeia da polimerase (PCR) e análise de expressão gênica.
- Quantificação da diferenciação:
Em alguns casos, é necessário quantificar o grau de diferenciação celular. Isto pode ser feito contando células diferenciadas em relação ao número total de células ou empregando ensaios específicos para marcadores de diferenciação.
Através da avaliação e fotodocumentação da diferenciação celular por microscopia invertida é possível identificá-la em três linhagens celulares: osteogênese (coloração com Alizarin Red S), adipogênese (coloração Oil Red) e condrogênese (coloração com azul de toluidina), bem como ilustrado na figura abaixo. A imagem foi tirada por um dos estudos da Crop Biolabs:
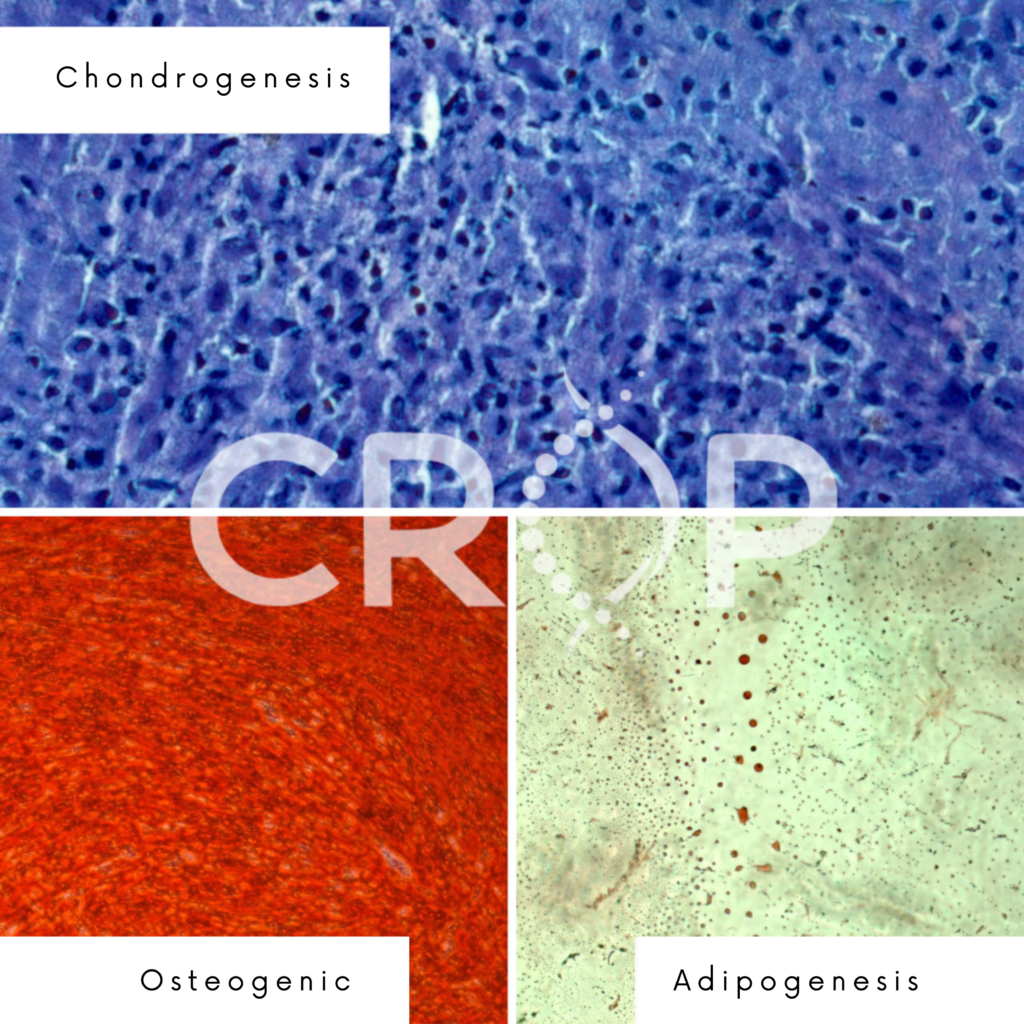
Este teste permite avaliar se as células utilizadas no produto de terapia avançada conseguem diferenciar-se adequadamente e, assim, desempenhar a função terapêutica desejada. É fundamental estabelecer critérios de qualidade e especificações pré-definidas para a diferenciação celular, garantindo a consistência e eficácia do produto final.
Quantificação de Impurezas e Metabólitos
Outra metodologia valiosa para validação e controle de qualidade de produtos de terapia avançada é a quantificação de impurezas e metabólitos, que visa identificar e quantificar a presença de impurezas indesejáveis, bem como avaliar a presença de metabólitos que possam afetar a segurança e eficácia. do produto.
Esta metodologia pode ser realizada utilizando diversas técnicas analíticas, dependendo da natureza das impurezas ou metabólitos a serem quantificados, como ensaios enzimáticos ou imunoensaios, cromatografia líquida e espectrometria de massa.
A técnica de cromatografia líquida acoplada à espectrometria de massas (LC-MS) tem sido amplamente utilizada na avaliação da quantificação de impurezas e metabólitos, pois oferece alta sensibilidade, seletividade e capacidade de identificar compostos presentes em amostras complexas.
A Cromatografia Líquida (LC) é empregada para separar os componentes da amostra com base em suas características químicas, como polaridade, tamanho e afinidade de fase estacionária. Existem diferentes modos de LC que podem ser utilizados, como cromatografia líquida de fase reversa (RP-LC), cromatografia de troca iônica (IC) e cromatografia de exclusão molecular (SEC), entre outros. A escolha do modo LC depende das características dos compostos a serem analisados.
Após a separação cromatográfica, os compostos eluídos são direcionados para Espectrometria de Massas (EM), onde ocorre a ionização dos compostos e sua fragmentação em íons, que posteriormente são detectados. MS permite a identificação de compostos com base em suas massas moleculares e relações massa-carga (m/z). Além disso, a técnica LC-MS permite quantificar os compostos presentes na amostra através da relação entre a intensidade do sinal e a concentração conhecida de um padrão interno ou externo.
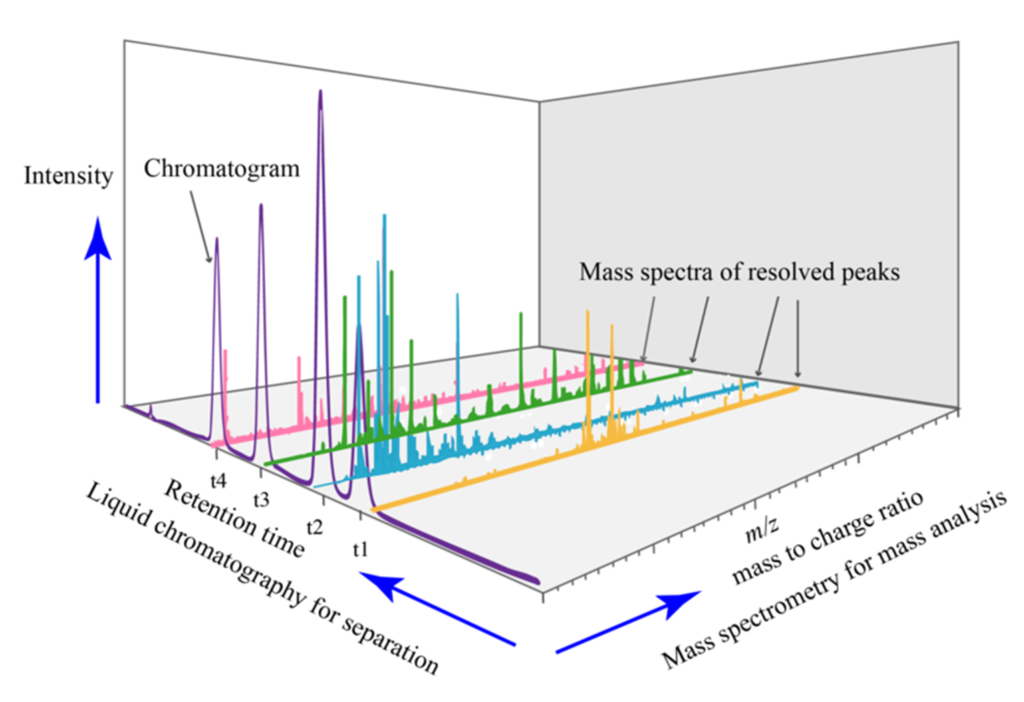
No contexto do controle de qualidade de terapias avançadas, a LC-MS pode ser utilizada para quantificar impurezas, como resíduos de reagentes ou produtos de degradação, que possam estar presentes nos produtos. Além disso, a técnica pode ser aplicada para quantificar metabólitos endógenos ou exógenos produzidos por células ou tecidos terapêuticos após administração do produto.
É importante ressaltar que a LC-MS requer preparação adequada da amostra, incluindo extração, purificação e pré-concentração dos compostos de interesse. Além disso, é necessário utilizar padrões de referência para quantificação precisa dos analitos. A validação da metodologia LC-MS é essencial para garantir a robustez, sensibilidade e precisão dos resultados obtidos.
O uso preciso da técnica LC-MS proporciona a detecção e quantificação de lactato, glutamina/glutamato, amônia e glicose em amostras de sobrenadantes de culturas celulares, que são importantes indicadores do metabolismo celular (refletindo a atividade e a saúde das células terapêuticas) e podem estar associado a impurezas e produtos de degradação indesejados em produtos de terapia avançada. Assim, a detecção destes indicadores é importante na avaliação do metabolismo celular e da qualidade do meio de cultura, contribuindo para o controle de qualidade e segurança de terapias avançadas.
Mais detalhes sobre a detecção e quantificação de impurezas e metabólitos podem ser encontrados no Tópico Q3 do Conselho Internacional para Harmonização de Requisitos Técnicos de Registro de Produtos Farmacêuticos para Uso Humano (ICH) da EMA.
Detecção de micoplasma
A detecção de micoplasmas também é uma metodologia importante para o controle de qualidade de produtos de terapia avançada. Isto ocorre porque os micoplasmas são organismos microscópicos que podem contaminar culturas celulares e representam uma preocupação significativa no comprometimento da segurança e eficácia dos produtos.
A contaminação por micoplasma pode ocorrer durante o cultivo celular ou através de fontes externas, como reagentes, meio de cultura ou contaminação cruzada. Os micoplasmas podem causar alterações na fisiologia celular, inibindo o crescimento, prejudicando a viabilidade e interferindo nas características funcionais das células terapêuticas.
É importante destacar que a detecção de micoplasmas é uma exigência regulatória para produtos de terapia avançada, sendo exigida pelas agências reguladoras. Além disso, é fundamental a realização regular de testes para detecção de micoplasma durante o desenvolvimento, produção e controle de qualidade de produtos de terapia avançada, garantindo sua segurança e qualidade.
Existem diversas técnicas disponíveis para detecção de micoplasma em produtos de terapia avançada, como cultura em meio seletivo, coloração DAPI (4′,6-diamidino-2-fenilindole), Ensaio de Hibridização de Ácido Nucleico e RT-qPCR.
A técnica molecular de RT-qPCR (Reação em cadeia da polimerase em tempo real) é amplamente utilizada para detecção de micoplasma, detectando a presença de gDNA com primers específicos para regiões intergênicas 16S-23S de espécies de Mycoplasma com maior incidência de contaminação de cultura celular ( M. arginina, M. fermentans, M. hominis, M. hyorhinis, M. orale, M. salivarium, M. pirum, A. laylawii).
Nos “Pontos da FDA a serem considerados na caracterização de linhas celulares usadas para produzir produtos biológicos”. é possível apreciar mais detalhes sobre a detecção de Mycoplasma.
Teste de esterilidade
O teste de esterilidade é outra metodologia fundamental no controle de qualidade de produtos de terapia avançada. Tem como objetivo verificar se um produto está livre de microrganismos viáveis, como bactérias, fungos e vírus, que podem causar infecções ou comprometer a segurança do paciente.
Produtos de terapia avançada, como terapia celular, terapia gênica e produtos de engenharia de tecidos, são produzidos em ambientes complexos e podem estar expostos a riscos de contaminação durante diversas etapas do processo, desde a coleta da matéria-prima até a manipulação em laboratório, dificultando o teste de esterilidade. essencial para garantir a qualidade e segurança destes produtos.
Existem diferentes métodos para realizar o teste de esterilidade, sendo os mais comuns:
- Método de filtro de membrana:
Neste método, uma amostra do produto é filtrada através de uma membrana com poros de tamanho definido, geralmente 0,45 ou 0,2 micrômetros. A membrana retém os microrganismos presentes na amostra, que é posteriormente incubada em meios de cultura apropriados para permitir o crescimento dos microrganismos. A ausência de crescimento após o período de incubação indica que o produto é estéril.
- Método de Inoculação Direta:
Neste método, uma quantidade específica do produto é transferida para um meio de cultura estéril e apropriado. O meio de cultura é incubado e observado quanto ao crescimento de microrganismos ao longo do tempo. A ausência de crescimento após a incubação indica a esterilidade do produto.
A detecção de bactérias anaeróbias e aeróbias, leveduras e fungos é frequentemente realizada por inóculo de amostras em caldo de tioglicolato e caseína de soja no teste de esterilidade para controle de qualidade de terapias avançadas. Isso porque esses meios de cultura favorecem o crescimento de diversos tipos de microrganismos e aumentam a sensibilidade do teste de esterilidade.
O Caldo Tioglicolato é um meio de cultura enriquecido que fornece condições adequadas para o crescimento de uma ampla variedade de microrganismos, incluindo bactérias anaeróbias e aeróbicas. Este meio contém nutrientes que apoiam o crescimento tanto de microrganismos que necessitam de oxigênio quanto daqueles que crescem melhor na ausência de oxigênio. Portanto, o inóculo de amostras em caldo de tioglicolato permite a detecção de bactérias aeróbias e anaeróbias presentes em produtos de terapia avançada.
A caseína de soja é outro meio de cultura utilizado para testes de esterilidade. Este meio é rico em nutrientes e permite o crescimento de bactérias, leveduras e fungos. O inóculo das amostras em caseína de soja permite detectar a contaminação por estes microrganismos.
No teste de esterilidade, amostras de produtos de terapia avançada são inoculadas em frascos contendo caldo de tioglicolato e caseína de soja. Os frascos são incubados em condições adequadas, como temperatura e atmosfera controladas, por um tempo especificado. Após a incubação, os frascos são observados quanto ao crescimento microbiano, tal como turvação ou formação de colónias visíveis.
A detecção de crescimento microbiano no meio de cultura indica que o produto não está estéril, indicando a presença de contaminação. Embora a ausência de crescimento microbiano e sua esterilidade.
É importante observar que os requisitos regulamentares e as diretrizes para estes procedimentos podem variar entre os diferentes produtos de terapia avançada. Além disso, a validação destes métodos é essencial para garantir a sua eficácia e fiabilidade.
A detecção de bactérias anaeróbias e aeróbias, leveduras e fungos através do inóculo de amostras em caldo de tioglicolato e caseína de soja no teste de esterilidade é uma abordagem amplamente utilizada e reconhecida para o controle de qualidade de terapias avançadas e permite identificar contaminações microbianas que podem comprometer a segurança e eficácia dos produtos.
A realização regular de testes de esterilidade em produtos de terapia avançada garante que os produtos estejam livres de microrganismos viáveis, reduzindo o risco de infecção e garantindo a segurança do paciente. É uma etapa crucial no controle de qualidade para garantir que os produtos atendam aos padrões exigidos pelas autoridades reguladoras e pelas boas práticas de fabricação.
Análise de endotoxina
A análise de endotoxinas é outra metodologia vital para o controle de qualidade de produtos de terapia avançada. Por serem componentes bacterianos lipopolissacarídeos (LPS) presentes nas paredes celulares de bactérias Gram-negativas, a presença de endotoxinas em produtos terapêuticos pode representar um risco significativo à segurança do paciente, pois têm potencial para desencadear reações inflamatórias e imunológicas adversas.
A análise de endotoxinas é geralmente realizada usando o método Gel Clot Limulus amebócitos lisado (LAL), que se baseia na capacidade das endotoxinas de ativar a cascata de coagulação do lisado de amebócitos Limulus (LAL). LAL é um reagente derivado do sangue do caranguejo-ferradura (Limulus polyphemus), que contém amebócitos (células sanguíneas) sensíveis a endotoxinas. Quando as endotoxinas estão presentes, ocorre a coagulação do LAL, que pode ser quantificada e utilizada para determinar a quantidade de endotoxinas presentes na amostra.
A análise de endotoxinas é especialmente relevante para produtos de terapia avançada que envolvem materiais biológicos, como culturas celulares, meios de cultura, soluções de armazenamento e dispositivos médicos. Estes materiais podem ser fontes potenciais de contaminação bacteriana e, portanto, podem conter endotoxinas.
Os limites permitidos de endotoxinas em produtos de terapia avançada são definidos por agências reguladoras e, portanto, devem ser testados quanto à presença de endotoxinas de acordo com requisitos regulamentares específicos.
É importante mencionar que a análise de endotoxinas deve ser realizada por métodos e padrões pouco reconhecidos, como o capítulo <85> da Farmacopeia dos Estados Unidos (USP) e o capítulo 2.6.14 da Farmacopeia Europeia (EP). Além disso, é necessário garantir a validação do método, incluindo a verificação da sensibilidade e especificidade do teste.
Detecção e quantificação de dimetilsulfóxido (DMSO)
A detecção e quantificação do dimetilsulfóxido (DMSO) pode fazer parte do controle de qualidade de produtos terapêuticos, principalmente daqueles que utilizam o DMSO como componente importante no processo de fabricação ou preservação.
DMSO é um solvente amplamente utilizado em pesquisas biológicas e terapias avançadas. Pode ser utilizado como crioprotetor, auxiliando na preservação de células e tecidos durante o processo de congelamento e armazenamento a longo prazo. No entanto, é importante garantir que os produtos finais não exagerem com níveis excessivos de DMSO, pois concentrações elevadas podem ter efeitos tóxicos nas células e tecidos.
A detecção e quantificação do DMSO pode ser realizada através da técnica de cromatografia líquida de alta eficiência (HPLC) acoplada à espectrometria de massa (MS), permitindo a separação e identificação do DMSO na amostra, bem como a quantificação precisa de sua concentração.
No processo de controle de qualidade, amostras de produtos são preparadas e analisadas seguindo requisitos e diretrizes regulatórias aplicáveis, estabelecendo limites aceitáveis para concentração de DMSO com base em estudos de segurança e eficácia. Amostras do produto testado são comparadas com esses limites de segurança para garantir a conformidade.
Ao manter as concentrações de DMSO dentro dos limites estabelecidos, é possível minimizar seus efeitos tóxicos e preservar a viabilidade e funcionalidade de células e tecidos utilizados em terapias avançadas, tornando o ensaio de detecção e quantificação de DMSO uma parte essencial do controle de qualidade do produto que o utiliza.
É importante ressaltar que a metodologia exata para detectar e quantificar o DMSO pode variar dependendo dos requisitos específicos do produto e das diretrizes regulatórias aplicáveis. Portanto, é fundamental seguir práticas adequadas e métodos validados para garantir resultados confiáveis e precisos.
Detecção de penicilina e estreptomicina
Assim como o ensaio de detecção e quantificação de DMSO, o teste de detecção de penicilina e estreptomicina torna-se parte essencial do controle de qualidade dos produtos de terapia avançada que os utilizam durante seu processo de fabricação ou caso haja possibilidade de contaminação cruzada com essas substâncias.
A penicilina e a estreptomicina são antibióticos amplamente utilizados no tratamento de infecções bacterianas. Contudo, em certos casos, a presença destes antibióticos em produtos terapêuticos pode ser indesejável.
Para a detecção de penicilina e estreptomicina, a técnica mais utilizada também é a cromatografia líquida acoplada à espectrometria de massas (LC-MS), que permite o processo de separação e identificação dos antibióticos na amostra, bem como a quantificação precisa de suas concentrações .
Análise de proteína total (BCA)
A análise de proteínas totais pelo método BCA (bicinchoninato de cobre) pode ser uma metodologia importante para o controle de qualidade de produtos de terapia avançada. A quantificação de proteínas totais é relevante, pois fornece informações sobre a concentração de proteínas presentes no produto, o que é importante para garantir a consistência e qualidade do produto final.
O método BCA é uma técnica colorimétrica baseada na reação entre a proteína presente na amostra e o reagente BCA. O reagente forma um complexo colorido com as proteínas em solução, e a intensidade da cor é diretamente proporcional à concentração de proteínas presentes. Essa intensidade pode ser medida utilizando técnicas como Western-Blot para quantificar a concentração de proteínas na amostra.
A análise da proteína total utilizando o método BCA pode ser realizada em vários estágios do processo de fabricação do produto de terapia avançada. Por exemplo, é comum realizar esta análise para verificar a concentração de proteínas em meios de cultura, soluções de armazenamento e produtos derivados de células ou tecidos, entre outros.
Ao realizar a análise de proteínas totais, é importante seguir os procedimentos adequados e estabelecer um protocolo validado. Isto envolve a preparação correta da amostra, a adição do reagente BCA e uma leitura espectrofotométrica precisa para quantificar a concentração de proteína. Além disso, é importante utilizar um padrão de proteína de referência para calibrar a curva de calibração e garantir resultados confiáveis e comparáveis.
Imunofenotipagem de células-tronco mesenquimais
As células-tronco mesenquimais (CTMs) são células multipotentes capazes de se diferenciar em diversos tipos celulares, sendo amplamente utilizadas em pesquisas e aplicações terapêuticas devido às suas propriedades regenerativas e imunomoduladoras.
A imunofenotipagem de MSC é um processo que envolve a marcação e detecção de antígenos específicos na superfície das MSC usando anticorpos monoclonais. Estes anticorpos podem ser conjugados com marcadores fluorescentes ou enzimáticos para permitir a identificação e caracterização de MSCs. Através da imunofenotipagem é possível avaliar a presença ou ausência de marcadores de superfície específicos nas CTMs, o que auxilia na identificação e caracterização dessas células.
No controle de qualidade de terapias avançadas utilizando CTMs, a imunofenotipagem é amplamente utilizada para confirmar a identidade das células e avaliar sua pureza e viabilidade. Isto é especialmente importante porque a presença de outras células contaminantes pode afetar a segurança e eficácia do produto final.
Através da imunofenotipagem é possível identificar marcadores específicos de CTMs, como CD73, CD90 e CD105, e excluir a presença de marcadores celulares indesejáveis, como CD45 (marcador de células do sistema imunológico) e CD34 (marcador de células progenitoras hematopoiéticas). células).
Além disso, a imunofenotipagem também pode ser utilizada para monitorar a qualidade e consistência das CTMs ao longo do tempo, permitindo a avaliação de alterações nas características fenotípicas das células durante a expansão in vitro. Isto é importante para garantir a estabilidade das marcas comunitárias e manter a conformidade com os requisitos de qualidade e eficácia.
A imunofenotipagem de MSCs é realizada por citometria de fluxo, técnica que permite a análise simultânea de múltiplos parâmetros de fluorescência em células individuais. Os resultados da imunofenotipagem são interpretados comparando padrões de expressão de marcadores em MSCs com controles apropriados e com perfis fenotípicos conhecidos de MSCs, com interpretação de positividade quando ≥ 95% positivo para CD73, CD90 e CD105 e ≤ 2% negativo para CD34, CD45, CD11b ou CD14, CD19 ou CD79α e HLA-DR (Sociedade Internacional de Terapia Celular).
Virologia molecular
A virologia molecular desempenha um papel essencial no controlo de qualidade de terapias avançadas, permitindo a detecção e quantificação de ácidos nucleicos de diferentes vírus presentes em produtos terapêuticos. Para isso, são utilizadas diversas técnicas, como RT-qPCR, TCID50 (dose infecciosa 50%) e título viral infeccioso.
RT-qPCR é uma técnica sensível e específica que permite a detecção e quantificação de ácidos nucleicos virais em amostras. Combina transcrição reversa (RT), que converte o RNA viral em DNA complementar (cDNA), e PCR em tempo real, que amplifica e quantifica o cDNA viral. RT-qPCR é comumente usado para a detecção de vírus como CMV (citomegalovírus), HIV-1 e HIV-2, HTLV-I e HTLV-II, EBV (vírus Epstein-Barr), HBV (vírus da hepatite B), HCV (vírus da hepatite C) e B19 (parvovírus humano B19).
A técnica TCID50 é usada para determinar a concentração de partículas virais infecciosas em uma amostra. TCID50 significa “dose infecciosa de 50%”, que é a diluição da amostra que resulta em 50% de células infectadas. Este método é frequentemente utilizado para avaliar a infecciosidade de vírus em produtos terapêuticos, tais como culturas de células ou preparações virais.
O título viral infeccioso é outra abordagem para quantificar a concentração de partículas virais infecciosas. Este método mede a quantidade de vírus capaz de infectar células-alvo em uma amostra. Geralmente envolve diluição em série da amostra, inoculação em células apropriadas e avaliação do efeito citopático (morte ou alteração celular) após um determinado período de incubação. O título viral infeccioso é particularmente útil para avaliar a presença e atividade de vírus infecciosos em terapias avançadas.
A utilização destas técnicas de virologia molecular, como RT-qPCR, TCID50 e títulos virais infecciosos, no controle de qualidade de terapias avançadas permite a detecção, quantificação e avaliação da atividade viral em produtos terapêuticos. Estas metodologias são essenciais para garantir a segurança do produto e minimizar o risco de transmissão viral aos pacientes.
Abordagem de corte
A Crop Biolabs é uma instalação externa integrada de P&D, especializada em uma variedade de serviços pré-clínicos e analíticos, avaliação externa de qualidade e ensaios fenotípicos e moleculares para empresas terapêuticas baseadas em células, produtos farmacêuticos, ingredientes cosméticos e sanitizantes, além de fornecer fundamentação de reivindicações e avaliações de segurança desde a descoberta até a regulamentação para novas soluções e produtos sob medida.
Nossa equipe de desenvolvimento de produtos oferece Controle de Qualidade e validação para terapias celulares alinhadas às normas regulatórias da ANVISA, FDA e EMA, e inclui em seu portfólio todas as metodologias apresentadas no artigo (ensaio de diferenciação celular, quantificação de impurezas e metabólitos, detecção de micoplasma, teste de esterilidade, análise de endotoxinas, detecção e quantificação de DMSO, penicilina e estreptomicina, análise de proteínas totais, imunofenotipagem de CTMs e virologia molecular), de forma personalizada, ágil, econômica e humanizada.
Nossa missão é colaborar com o amadurecimento tecnológico de produtos e desenvolvimentos em ciências da vida, seja com um atendimento pontual ou com uma solução completa de P&D: da ideia ao impacto.
Saiba mais sobre a Crop Labs e entre em contato. Vamos trabalhar juntos: https://crop-labs.com
Referências:
- Conselho Internacional para Harmonização de Requisitos Técnicos Registro de Produtos Farmacêuticos para Uso Humano (ICH) Tópico Q3 , EMA;
- Pontos da FDA a serem considerados na caracterização de linhas celulares usadas para produzir produtos biológicos;
- Farmacopeia Brasileira, 6ª edição teste de esterilidade (5.5.3.2.1);
- Centro de Avaliação e Pesquisa Biológica da FDA AVANÇO DA CIÊNCIA REGULATÓRIA – Escritório de Tecidos e Terapias Avançadas Divisão de Terapias Celulares e Genéticas Ramo de Terapia Celular e Tecidual;
- Medicamentos à base de células estaminais da EMA – Orientação científica.





0 comentários